

Antibiotika
Die Bezeichnung "antimikrobielle Substanzen" wird für Wirkstoffe synthetischen oder natürlichen Ursprungs, welche das Wachstum von Mikroorganismen unterbinden oder hemmen, verwendet. Dazu gehören Antibiotika, antivirale Mittel, Antimykotika und Antiparasitika.
Antibiotika sind Substanzen mit antibakterieller Wirkung, welche in der Lage sind, das Wachstum von Bakterien zu hemmen (= bakteriostatische Wirkung) oder diese abzutöten (= bakterizide Wirkung). Antibiotika werden überwiegend als Arzneimittel zur Behandlung von bakteriellen Infektionskrankheiten eingesetzt.
Resistenzen
Unter einer Resistenz eines Bakteriums wird generell eine Unempfindlichkeit gegenüber einem Wirkstoff verstanden. Bestimmte Erreger weisen intrinsische Resistenzen gegen bestimmte Substanzen auf (primäre Resistenz), d.h. sie sind gegenüber bestimmten Wirkstoffen unempfindlich, da der Wirkmechanismus per se nicht greifen kann. Im Gegensatz zur intrinsischen Resistenz kann eine Resistenz gegenüber ursprünglich wirksamen Antibiotika erworben werden (sekundäre Resistenz). In der Regel wird diese erworbene Form der Resistenz mit dem Begriff Antibiotikaresistenz bezeichnet. Der Einsatz von Antibiotika übt Druck auf die Bakterien aus, der eine Resistenzentstehung und –verbreitung fördert. Letzteres wird häufig auch als Selektionsdruck bezeichnet. Die Wahrscheinlichkeit der Resistenzselektion ist von einer Reihe von Faktoren abhängig, wie z. B. der Dosierung, der Anzahl der behandelten Individuen, der Behandlungsdauer, der Art des Wirkstoffes, des Wirkungsspektrums und des Resistenzmechanismus.
Minimale Hemmkonzentration
Die Empfindlichkeit eines Keims gegenüber einem bestimmten Wirkstoff kann man (semi-) quantitativ über die Anwendung eines Testverfahrens, meist unter Verwendung verschiedener Konzentrationen des Wirkstoffs, bestimmen. Bei der minimalen Hemmkonzentration (MHK) handelt es sich um die kleinste Konzentration eines antimikrobiellen Wirkstoffes, bei dem kein Bakterienwachstum mehr zu beobachten ist. Der MHK-Wert kann anhand unterschiedlicher Methoden bestimmt werden. Dieser Wert hilft, um eine therapeutische Entscheidung bezüglich der Wirksamkeit des einzusetzenden Antibiotikums treffen und die Resistenzlage (z.B. beginnende Resistenzentwicklung) einschätzen zu können.
Testbereich
Werden in einem Test verschiedene Konzentrationen eingesetzt, so müssen diese vorab festgelegt werden. Die Auswahl dieses Konzentrationsbereichs, der getestet wird, um einen MHK-Wert zu bestimmen, hängt von verschiedenen Kriterien ab, beispielsweise den erreichbaren therapeutischen Wirkspiegeln, rechtlichen Regelungen oder der geplanten Anwendung von vorliegenden Grenzwerten, die aussagekräftig für die Wirksamkeit der Substanzen im Körper sind. Neben Empfehlungen für die zu testenden Konzentrationen der unterschiedlichen Substanzen durch Organisationen wie EUCAST und CLSI (siehe unten), wird der getestete Bereich auch zum Teil von Laboren individuell festgelegt.
Erregerisolierung:
Um bei der Empfindlichkeitstestung aussagekräftige Ergebnisse zu erhalten, muss der zu untersuchende bakterielle Erreger als Reinkultur vorliegen. Dafür muss der Erreger zunächst aus dem klinischen Material isoliert werden. Die Gewinnung von Reinkulturen kann insbesondere bei Mischkulturen in der Probe mehrere Schritte mit unterschiedlich zusammengesetzten Nährmedien (teilweise Selektivnährmedien, die Antibiotika enthalten) und unterschiedlichen Wachstumsbedingungen erforderlich machen. Die Reinkultur kann dann auf Resistenzen getestet werden. Die dafür gewählte Methode richtet sich auch nach den Wachstumsbedingungen des Zielkeims.
Breit- vs. Schmalspektrumantibiotika
Antibiotika können unterteilt werden nach der Breite des Spektrums ihrer Wirksamkeit. Einige Antibiotika wirken nur gegen einen oder einige wenige Erreger (Schmalspektrum), während andere mit ihrer Wirkung ein größeres Spektrum an grampositiven oder gramnegativen Bakterien (Breitspektrum) erfassen.
Long vs. Short Acting Arzneimittel
Antibiotika-haltige Arzneimittel können weiterhin nach ihrer Wirkdauer unterschieden werden. Dabei unterteilt man in solche Formulierungen, die kürzer als 24 Stunden wirken (short acting) und solche, die 24 Stunden oder länger ihren Wirkspiegel aufrechterhalten (long acting).
HPCIA Antibiotika
Die Weltgesundheitsorganisation (WHO) hat in ihrer Liste "List of critically important antimicrobials" alle antimikrobiell wirksamen Stoffe nach ihrer Bedeutung für die Humanmedizin eingeteilt. Die so genannten HPCIA (highest priority critically important antimicrobials) sind jene Antibiotika mit höchster Priorität, die nur eingesetzt werden sollen, wenn es keine alternative Behandlungsmöglichkeit gibt. Sie umfassen folgende, in der Veterinärmedizin zugelassene Wirkstoffgruppen: Cephalosporine der 3. und 4. Generation, Makrolide, Polymyxine und Chinolone.
Methoden zur Empfindlichkeitstestung von Bakterien
Welche Methode für eine Empfindlichkeitstestung verwendet wird, hängt von verschiedenen Faktoren ab: z.B. dem Erreger, dem Spektrum der zu testenden Wirkstoffe und dem Diagnostiklabor. Zudem existieren unterschiedliche (international) anerkannte Standards zur Testung, die unterschiedliche inhaltliche Schwerpunkte und damit unterschiedliche Ausprägungen haben. Welche Methode zur Empfindlichkeitstestung zu verwenden ist, ist daher vom Ziel der Untersuchung abhängig, so dass es je nach Ziel statthaft ist, unterschiedliche Methoden zu verwenden. Wenn beispielsweise anspruchsvolle Erreger spezielle Anforderungen an das Nährmedium stellen oder besondere Testkonditionen erfordern, muss dies entsprechend bei der Auswahl der Methodik berücksichtigt werden. Generell ist es erforderlich, dass viel Sorgfalt auf die korrekte Durchführung der verwendeten Methoden verwendet wird.
In der Praxis gängig ist der Agardiffusionstest, der E-Test sowie die Bouillon-Mikrodilutionstestung. Es werden aber nachfolgend aus weitere Methoden vorgestellt.
Agardiffusionstest
Bei der Agardiffusion wird ein fester Nährboden (Agarplatte) mit einem Inokulum (Konzentration einer Reinkultur von Mikroorganismen) beimpft, indem eine genau definierte Menge an Bakteriensuspension gleichmäßig auf der Agarplatte ausgestrichen wird. Danach werden Testplättchen auf den Nährboden gelegt, welche den antimikrobiellen Wirkstoff mit jeweils einer bestimmten Menge enthalten, und die Platte für eine bestimmte Zeit unter festgelegten Bedingungen inkubiert. Dabei können auf einer einzelnen Agarplatte gleichzeitig mehrere antimikrobielle Wirkstoffe getestet werden. Während der Inkubation diffundiert der Wirkstoff vom Plättchen in den Agar und hemmt ggf. das Wachstum der Bakterien (entsprechend der Erregerempfindlichkeit gegenüber den Wirkstoff). Anschließend werden die so genannten Hemmhöfe (Bereich ohne Bakterienwachstum) um die Plättchen gemessen und das Erregerisolat anhand von Grenzwerten aus internationalen oder nationalen Standards in die Kategorien "sensibel", "intermediär" oder "resistent" eingestuft. Vorteile dieser Methode liegen in ihrer relativ einfachen Durchführbarkeit und einer leichteren, individuelleren Zusammenstellung der zu testenden Wirkstoffe. Allerdings ist auch hier die korrekte Durchführung der Methodik zu beachten, wie z.B. die Verwendung der vorgeschriebenen Nährmedien in der erforderlichen Qualität, die Erregerdichte auf den Agarplatten, Inkubationstemperatur und –dauer entsprechend des gewählten Standards, damit eine korrekte Interpretation der Ergebnisse erfolgen kann.
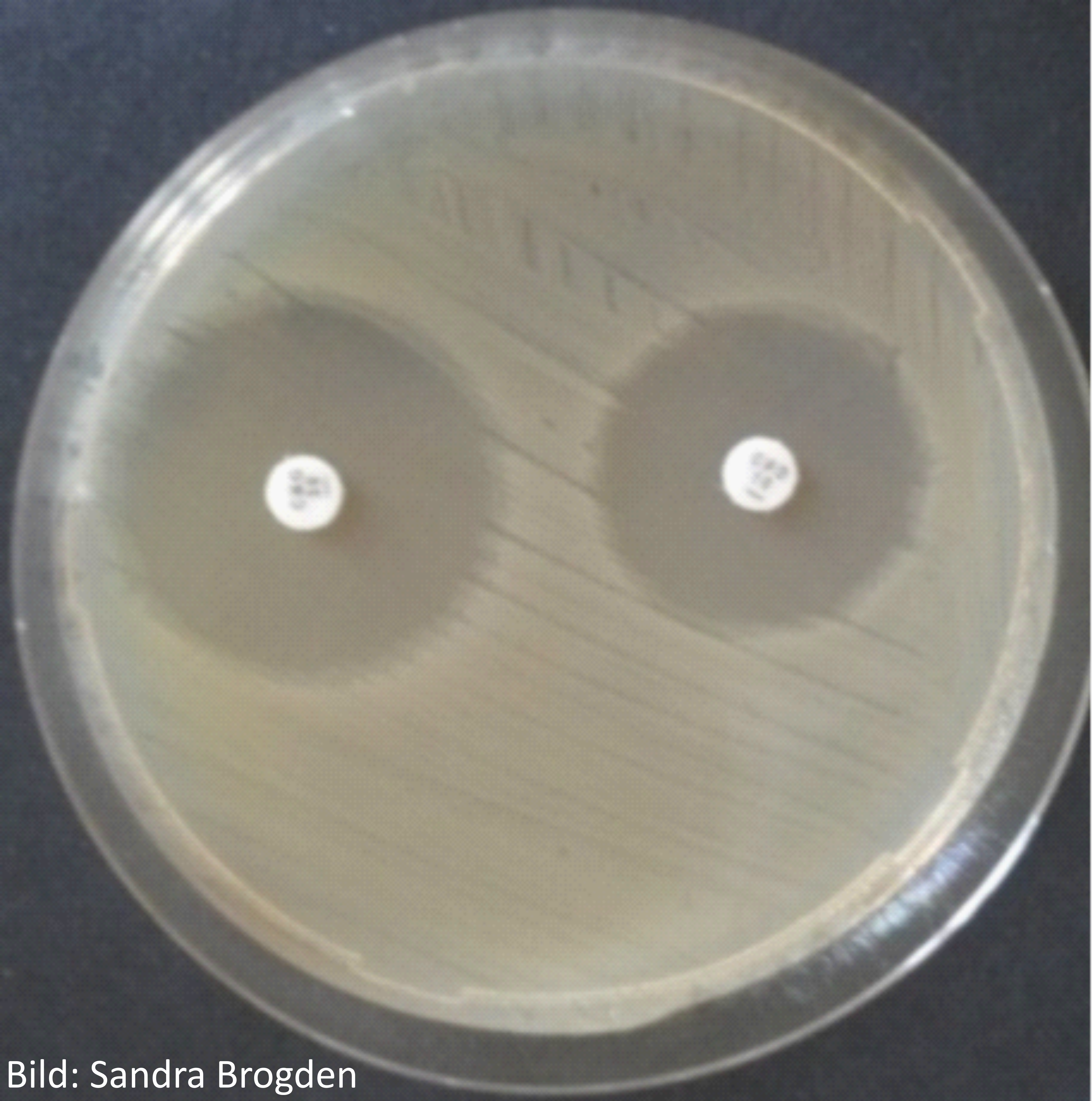
Abbildung 1: Agardiffusionstest mit dem Erreger E. coli auf Mueller-Hinton Agar
Epsilontest (E-Test)
Der E-Test stellt eine Kombination aus Agardiffusions- und Reihenverdünnungstest dar. Zunächst wird ebenfalls eine Reinkultur auf den Nährboden aufgebracht und anschließend ein kommerzieller E-Test Streifen mit einem Konzentrationsgradienten des antimikrobiellen Wirkstoffes aufgelegt. Nach einer festgelegten Inkubationszeit wird ein ellipsoider Hemmhof sichtbar. Das Ergebnis kann am unteren Schnittpunkt des Hemmhofes mit dem Teststreifen in Form des MHK-Wertes abgelesen werden (die Oberfläche des Teststreifens enthält eine Skala). Vorteile dieser Methode liegen in ihrer leichten Anwendbarkeit, der Tatsache, dass Ergebnisse in Form von MHK-Werten erhoben, sowie Erreger getestet werden können, die in Flüssigmedium nur schwaches oder kein Wachstum zeigen und die Auswahl der antimikrobiellen Wirkstoffe variabel zusammengestellt werden kann. Nachteile liegen im hohen Kosten- und Zeitaufwand, der Tatsache, dass nicht alle veterinärmedizinisch relevanten Wirkstoffe als Teststreifen erhältlich sind und keine standardisierten Durchführungsvorschriften vorliegen und somit keine standardisierte Bewertung möglich ist.
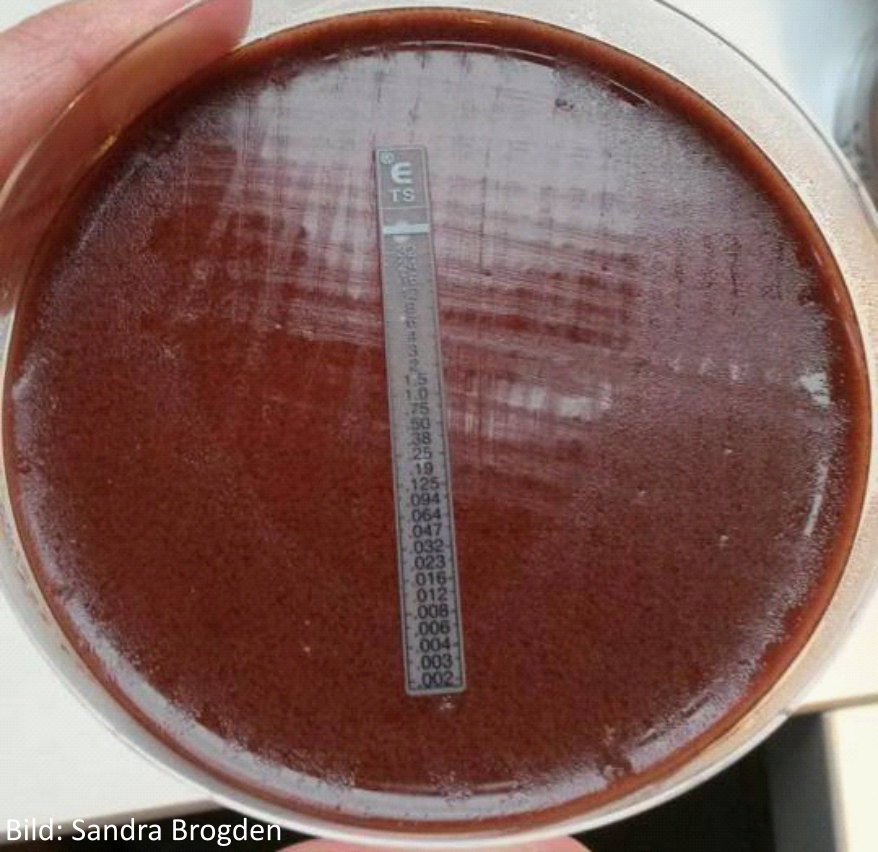
Abbildung 2: E-Test mit dem Erreger G. parasuis auf Kochblutagar
Reihenverdünnungstests
Bei den Reihenverdünnungstests werden Verdünnungsreihen des antimikrobiellen Wirkstoffes in einem festen oder flüssigen Nährmedium erstellt und mit einem spezifischen Inokulum beimpft. Nach Inkubation erfolgt die Auswertung auf das Vorliegen von Bakterienwachstum visuell. Die erste Verdünnungsstufe, bei der kein sichtbares Wachstum mehr vorhanden ist, entspricht dem MHK-Wert (Vorteil: quantitatives Ergebnis). Zu diesen Tests zählen die Agardilution, die Bouillon-Makrodilution und -Mikrodilution.
Agardilution
Bei der Agardilution (fester Nährboden) erhält jede Agarplatte eine spezifische Konzentration des Wirkstoffes, welche anschließend mit mehreren Bakterienisolaten beimpft werden kann. Die erste Platte mit einer Konzentration des Wirkstoffes, auf der kein Wachstum mehr sichtbar ist, definiert den MHK-Wert. Sie eignet sich besonders für anspruchsvolle Bakterien, die in einem Flüssigmedium nur schwaches Wachstum zeigen und bietet die Möglichkeit eine große Anzahl an Isolaten gleichzeitig und mit geringem Kostenaufwand zu bearbeiten. Andererseits stellt sie eine relativ aufwendige Methode der Empfindlichkeitstestung dar, da besonders auf eine gleichmäßige Verteilung des Wirkstoffes im Agar, die exakte Erstellung einer Verdünnungsreihe, sowie auf eine genaue Einhaltung der Temperatur bei Herstellung geachtet werden muss, da es ansonsten zu einem Konzentrationsverlust des Wirkstoffes kommen kann.
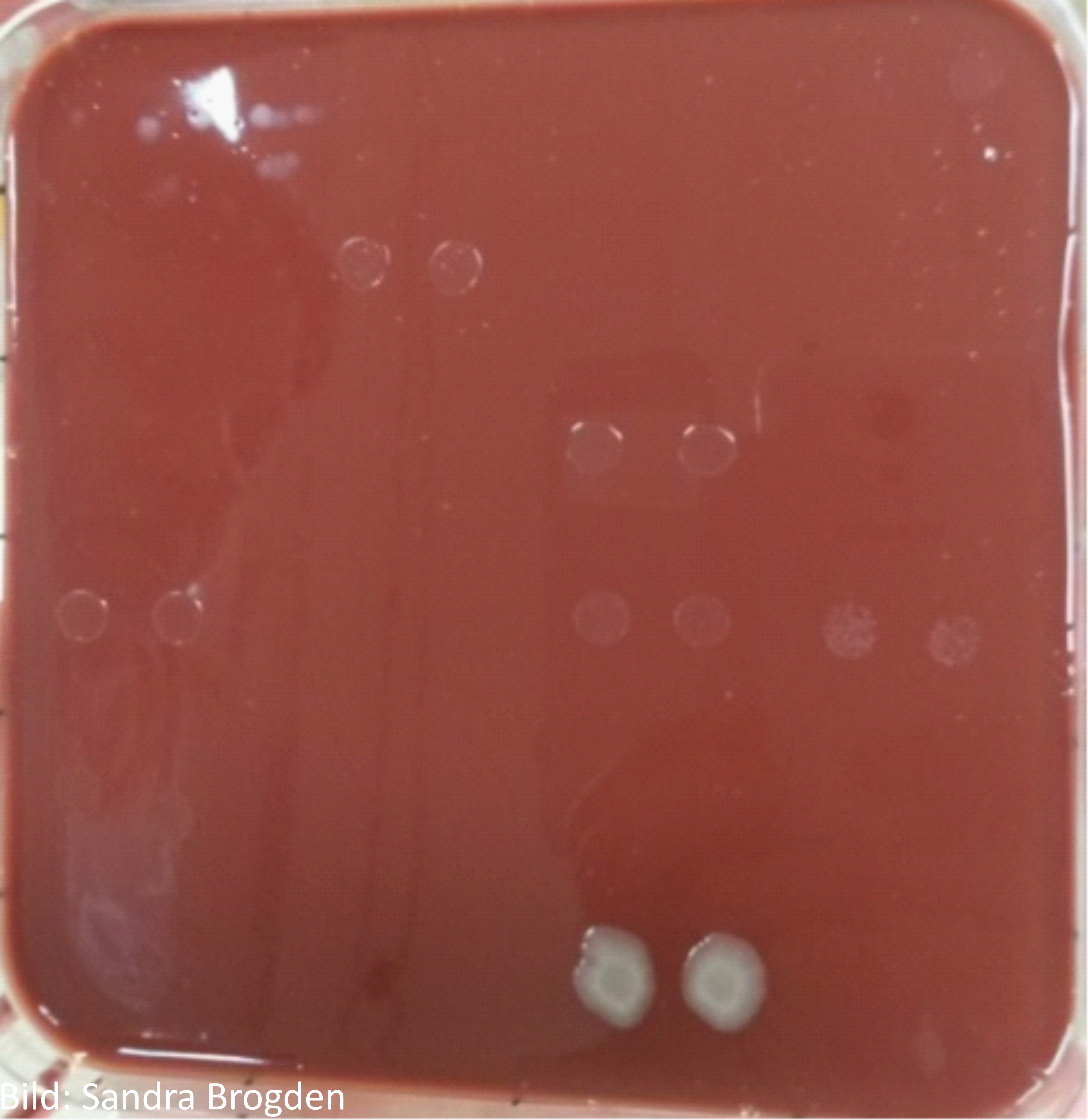
Abbildung 3: Agardilution mit dem Erreger G. parasuis und E. coli (ATCC 25922) als Qualitätskontrollstamm auf Kochblutagar
Bouillon-Makrodilution
Bei dieser Methode wird eine Verdünnungsreihe des zu testenden antimikrobiellen Wirkstoffes in einem Reagenzröhrchen mit Flüssigmedium erstellt. Jedes Röhrchen wird dabei mit einem Inokulum beimpft und anschließend inkubiert. Die erste Konzentrationsstufe, in der kein Wachstum mehr sichtbar ist, bestimmt den MHK-Wert. Neben einer quantitativen Beurteilung bietet diese Methode den Vorteil einer individuellen Auswahl der Wirkstoffe und Konzentrationsstufen. Nachteile liegen in der arbeits- bzw. zeitintensiven Herstellung der Verdünnungsreihen im Reagenzröhrchen und dem Verbrauch von relativ großen Mengen an Medium und Wirkstoff.

Abbildung 4: Makrodilution des Erregers B. bronchiseptica in Mueller-Hinton Bouillon
Bouillon-Mikrodilution
Bei der Bouillon-Mikrodilutionsmethode werden im Gegensatz zur Makrodilution viel kleinere Volumina an Nährsuspension verwendet. Die Testung erfolgt üblicherweise in kommerziellen Mikrotiterplatten, deren Vertiefungen bereits mit den antimikrobiellen Wirkstoffen beschichtet sind. Hierbei werden spezielle Layouts, wie z.B. angepasste Layouts für grampositive oder gramnegative Erreger, oder individuell gestaltete Layouts benutzt. Pro Mikrotiterplatte kann eine Vielzahl von Wirkstoffen und Konzentrationsstufen getestet werden, wobei mindestens zwei Vertiefungen für eine Wachstumskontrolle vorgesehen sind. Für die Durchführung wird eine Bakteriensuspension des zu testenden Erregers mit festgelegter Konzentration hergestellt und auf die einzelnen Vertiefungen aufgetragen. Die Auswertung erfolgt visuell oder automatisiert, wobei vorhandenes Bakterienwachstum bewertet wird (in Form einer Trübung oder Knopfbildung auf dem Boden der Vertiefungen). Der MHK-Wert entspricht der ersten Konzentrationsstufe des getesteten Wirkstoffes, bei der kein Wachstum des Erregers mehr sichtbar ist. Vom DVG-Arbeitskreis Antibiotikaresistenz wird sie derzeit als Methode der Wahl empfohlen, da sie sich durch hohe Reproduzierbarkeit und geringen Zeitaufwand (durch die Möglichkeit des Bezugs von mit antimikrobiellen Wirkstoffen beschichteten Mikrotiterplatten) auszeichnet und bereits automatisierte Systeme für die Empfindlichkeitstestung zur Verfügung stehen.

Abbildung 5: Bouillon-Mikrodilutionstestung des Erregers G. parasuis in Test Medium Bouillon
Relevanz einer Standardisierung der Empfindlichkeitstestung
In den verschiedenen internationalen und nationalen Standards zur Empfindlichkeitstestung von Bakterien finden sich Unterschiede in der empfohlenen Durchführung, in der Verwendung von Nährmedien, dem Einsatz von Supplementen, den Inkubationsbedingungen und der Konzentration des Inokulums. Entsprechend werden auch abweichende Grenzwerte zur Beurteilung der Ergebnisse in den unterschiedlichen Standards angegeben. Hierbei finden sich insbesondere auch Unterschiede bzgl. der Anwendungsbereiche der jeweiligen Grenzwerte, die zu beachten sind. Die exakte Durchführung und Auswertung der jeweiligen Methodik ist von besonderer Bedeutung und unterschiedliche Methoden dürfen nicht miteinander kombiniert werden. All dies gilt es zu berücksichtigen, so dass ein unmittelbarer Vergleich der erzielten Testergebnisse nicht immer gegeben ist. In der Konsequenz kann es zu einer unterschiedlichen Einstufung eines Erregers in die Kategorien "sensibel" oder "resistent" – in einigen Standards mit zusätzliche/n Kategorie/n "sensibel, bei höherer Dosierung" bzw. "sensibel, abhängig von der Dosierung" und/oder "intermediär" (genauere Informationen siehe CLSI M100 ED32:2022 und EUCAST V11) – kommen. All dies gilt es bei der Ableitung von Empfehlungen für den Einsatz des getesteten Wirkstoffes zu berücksichtigen.
Vorschriften zur Durchführung von Empfindlichkeitstestungen
CLSI
Das CLSI (Clinical and Laboratory Standards Institute) ist eine internationale Organisation, die aus Mitgliedern der Industrie, staatlichen Stellen und Fachpersonal des Gesundheitswesens besteht. Ihr Ziel liegt in der Entwicklung von Standards für Untersuchungen in der Labordiagnostik, damit es den Laboren ermöglicht wird, Ergebnisse von gleichbleibender Qualität und reproduzierbare Daten zu erzeugen. Der Unterausschuss für veterinärmedizinische antimikrobielle Empfindlichkeitstestung (VAST) setzt sich dabei vor allem dafür ein, dass Grenzwerte für die Veterinärmedizin etabliert werden und sich somit nicht auf die Grenzwerte aus der Humanmedizin gestützt werden muss.
Die Entwicklung der CLSI-Standards ist ein dynamischer Prozess, welcher durch die Mitwirkung aller Mitglieder gestaltet wird. Unterschieden wird zwischen
Die Standards zur Empfindlichkeitstestung, die Qualitätskontrollparameter und die Interpretationskriterien für die Ergebnisse stellen wichtige Informationen für eine reproduzierbare Durchführung von Empfindlichkeitstests dar. Für die Veterinärmedizin liegen Durchführungsvorschriften oder Methoden für die Empfindlichkeitstestung von einigen Bakterienarten tierischen Ursprungs vor. In den Dokumenten werden zudem Grenzwerte angegeben, wobei nicht für alle veterinärmedizinisch relevanten Erreger und Wirkstoffe Daten vorhanden sind (teilweise nur für eine bestimmte Tierart, ein bestimmtes Organsystem und/oder auch nur für ausgewählte antimikrobielle Wirkstoffe). Die Grenzwerte werden fortlaufend aktualisiert und erweitert.
EUCAST
EUCAST (European Commitee on Antimicrobial Susceptibility Testing) ist ein europäisches Gremium, dessen Hauptaufgabe darin besteht, MHK-Grenzwerte und Hemmhofgrößen für die antimikrobielle Empfindlichkeitstestung humanmedizinischer Erreger zu vereinheitlichen und in Zusammenarbeit mit der EMA (Europäische Arzneimittelagentur) klinische Grenzwerte für neue Wirkstoffe zu erarbeiten. Da diese MHK-Werte jedoch nur für die Humanmedizin gelten, wurde 2014 das veterinärmedizinische Gremium für antimikrobielle Empfindlichkeitstestung (VetCAST) gegründet. Es soll Grenzwerte für Krankheitserreger festlegen, welche von Tieren isoliert wurden oder die zoonotisches Potential besitzen, um damit eine Vereinheitlichung der antimikrobiellen Empfindlichkeitstestung, insbesondere der Bewertung der Ergebnisse, in der EU anzustreben.
Nationale Standards
National geben verschiedene Organisationen – beispielsweise das DIN (deutsches Institut für Normung) in Deutschland – ebenfalls Richtlinien oder Standards zur Empfindlichkeitstestung von Bakterien humanen Ursprungs heraus oder definieren spezifische MHK-Grenzwerte zur Einteilung der Erreger in "sensibel", "intermediär" und "resistent". Trotz einiger Gemeinsamkeiten liegen Abweichungen zwischen nationalen Methoden vor, wie z.B. Unterschiede in der Verwendung von Medien, der eingesetzten Inokulationskonzentrationen oder Inkubationsbedingungen. Zusätzlich können festgelegte Grenzwerte voneinander abweichen, da sie auf die jeweilige Methodik abgestimmt sind, wodurch es zu einer unterschiedlichen Einstufung von Erreger-Wirkstoff-Kombinationen kommen kann.
Klinische Grenzwerte (Breakpoints)
Ob eine Therapie mit einem Antibiotikum erfolgreich ist, hängt unter anderem davon ab, ob für den krankheitsverursachenden Erreger ein geeigneter Wirkstoff eingesetzt wird und dieser in der gewählten Formulierung das Zielgewebe erreichen kann. Aus diesem Grund ist es wichtig, den verantwortlichen Erreger zu isolieren und anschließend seine Empfindlichkeit gegenüber antimikrobiellen Wirkstoffen zu testen. Das Ziel ist, einen Wirkstoff einzusetzen, gegen den in-vitro keine Resistenz besteht. Für die Entscheidungsfindung werden klinische Grenzwerte benötigt, die den Erreger in die Kategorien
gegenüber den getesteten Wirkstoffen einstufen. Bei manchen anerkannten Standards zur Empfindlichkeitstestung gibt es noch eine weitere bzw. mehrere Kategorie/n: "sensibel, mit höherer Dosierung" bzw. "sensibel, abhängig von der Dosierung" und/oder "intermediär". Sie zeigen an, dass der Erfolg einer Therapie mit diesem Wirkstoff unsicher ist und daher, wenn möglich, ebenfalls vermieden werden sollte.
Klinische Grenzwerte werden unter Berücksichtigung des klinischen Erfolgs, von Pharmakodynamik und –kinetik eines antimikrobiellen Wirkstoffes sowie seiner Konzentration am Wirkungsort und seiner Dosierung festgelegt. Mit diesen Grenzwerten kann in einem Testsystem anhand festgelegter MHK-Werte eine Einteilung in oben genannte Kategorien erfolgen. Für einige veterinärmedizinisch wichtige Erreger liegen derzeit jedoch keine klinischen Grenzwerte vor, so dass eine Einteilung des Erregers in die Kategorien "sensibel", "intermediär" und "resistent" oft nicht möglich ist.
Epidemiologische Grenzwerte (ECOFFs)
Von den klinischen Grenzwerten müssen epidemiologische Grenzwerte (sogenannten ECOFFs – epidemiological cut-off values) abgegrenzt werden. Hierbei werden bakterielle Erreger in "Wildtyp" und "Nicht-Wildtyp" Stämme eingeteilt: der "Wildtyp" besitzt keine erworbenen Resistenzeigenschaften und stellt die "natürliche", sensible Bakterienpopulation dar (MHK-Wert < ECOFF-Wert: vermutlich keine Resistenzmechanismen), während der MHK-Wert des "Nicht-Wildtyp" über dem ECOFF liegt und somit vermutlich Resistenzmechanismen vorliegen. Seine Festlegung erfolgt unter Berücksichtigung von Bakterienisolaten aus unterschiedlichen Herkünften, Regionen und Zeitintervallen und eignet sich insbesondere für die Bewertung einer Population z.B. im Rahmen von epidemiologischer Studien oder für die Beobachtung der Resistenzentwicklung in einem Kollektiv. Der ECOFF ist nicht darauf ausgerichtet, zu beurteilen, ob ein bestimmter Wirkstoff für eine Therapie eines Patienten geeignet ist.
Wie unterschiedlich die Einteilung eines Erregers ausfallen kann, je nachdem welche Grenzwerte angelegt werden, zeigt Abbildung 6 am Beispiel von Amikacin-Resistenzen von Pseudomonas (P.) aeruginosa:
Die Abbildung zeigt am Beispiel von Amikacin-Resistenzen von Pseudomonas aeruginosa Isolaten (Grenzwerte entnommen aus der EUCAST Datenbank und aus CLSI VET01S; Stand 10. Mai 2022), dass je nach genutztem Grenzwert, die Einteilung in sensibel (S), intermediär (I) oder resistent (R) sehr unterschiedlich ausfallen kann.
Literatur
Prüller, S. Entwicklung von Methoden zur Empfindlichkeitstestung von Bordetella bronchiseptica und Haemophilus parasuis im Bouillon-Mikrodilutionsverfahren, 2016: 6-19
Haverkamp C. Antimikrobielle Therapie beim Nutzgeflügel: Auswertung von klinischer und mikrobieller Diagnostik, 2015: 39-46
WHO. List of Critically Important Antimicrobials for Human Medicine - 6th Revision. 2018.
Clinical and Laboratory Standards Institute (CLSI). Performance Standards for Antimicrobial Susceptibility Testing, 32nd ed. CLSI supplement M100, 2022
EUCAST: Veterinary Susceptibility Testing, (letzter Zugriff 16.12.2021)
EUCAST Datenbank: (https://mic.eucast.org/search/), (letzter Zugriff 10.05.2022)
VET01S Connect - CLSI VET01S ED5:2020 (edaptivedocs.net), (letzter Zugriff 10.05.2022)
DIN EN ISO 20776-1 - 2020-12 - Beuth.de, (letzter Zugriff 16.12.2021)
Brogden, S Abbildungen 1-5
Bonzelett, C Abbildung 6
Rekrutierung der Teilnehmer, Datenerfassung, Auswertung:
Tierärztin Clarissa Bonzelett
Tel.: +49 (0)511-953-7959
Clarissa.Bonzelett@tiho-hannover.de
Tierärztin Betty Rehberg
Tel.: +49 (0)511-953-7970
Betty.Rehberg@tiho-hannover.de